
江蘇吉泰肽業(yè)科技有限公司
聯(lián) 系 人 :秦經(jīng)理
座 機 :0515-84130555
手 機:17705109088
郵 箱:info@gtaipeptide.com
地 址:江蘇省鹽城市濱海縣新安大道799號
網(wǎng) 址:cn-cat.com.cn
郵 編:224500
有沒有人員對檢測限、定量限、報告限、忽略限及他們之間迷霧一般的關(guān)系有諸多困惑?在工作中、培訓(xùn)中也有很多人問過老王,一些問題可能重復(fù)解答過多次。閑暇之時,老王把自己對于他們及他們之間的錯綜關(guān)系和應(yīng)用要點進行梳理總結(jié),今天與大家聊聊,或可供參考。
一、定義與釋義:
檢測限D(zhuǎn)etection Limit(限度試驗):試樣中被測物質(zhì)被檢測出的最低量。從定義來看這一指標(biāo)只能用于限度檢查,而不能進行報告定量結(jié)果。
定量限Quantitation Limit(定量試驗):試樣中被測物質(zhì)被定量測定的最低量,其測定結(jié)果應(yīng)符合準(zhǔn)確度和精密度要求。(也是成線性范圍的最低濃度或量),可衡量方法靈敏度與定量檢測能力。
報告限(Reporting Threshold):高于此限度的降解產(chǎn)物需報告其含量。法規(guī)要求大于該限度必須報告的,是基于質(zhì)量可控性的科學(xué)性和嚴格性的平衡。
忽略限D(zhuǎn)isregard Limit:字面理解,低于此限度的雜質(zhì)可直接忽略不計,執(zhí)行層面可理解為低于此限度的單個雜質(zhì)可不報告,可不計入雜質(zhì)總和。
二、如何獲得檢測限、定量限、報告限?
定量限與檢測限是對于分析方法的檢出能力和靈敏度的測試,需經(jīng)方法驗證而得。
1、檢測限:通常的做法是配制一個溶液,通過稀釋獲得信噪比≥3:1的溶液作為定量限(日常為了方便稀釋與計算、以及看檢測限與定量限的對應(yīng)關(guān)系,通常可先做定量限,然后用定量限溶液再稀釋為檢測限)。
常見問題:方法驗證中,檢測限的信噪比大于10:1,是否還能將這個水平當(dāng)做檢測限?
當(dāng)然不能,既然信噪比已經(jīng)大于10:1,也就說明可以準(zhǔn)確定量了,為什么還要當(dāng)做檢測限,可能會導(dǎo)致一些雜質(zhì)不被報告。
2、定量限:通常的做法是配制一個溶液,通過稀釋獲得信噪比≥10:1的溶液作為定量限。也可直接用一定濃度的溶液直接進樣,信噪比>10:1即可。例如,報告閾值為0.05%,則可直接使用≤0.05%對應(yīng)的溶液進樣,查看信噪比符合即可。
3、做檢測限和定量限要點和注意事項
(1)選擇待測物質(zhì)附近(前、后)基線平滑的基線,時間持續(xù)1min左右即可,但是需要注意6針中的同一成分的選擇時間應(yīng)保持一致(日常工作中可能部分不理解定量限考察意義的人員會選擇遠離待測成分的基線,選擇時段可能也不一樣的情況)
(2)一定要是連續(xù)進樣,通常建議LOQ進樣6針(因其要符合準(zhǔn)確度和精密度要求),LOD進樣3針。
(3)LOQ信噪比6針均要≥10:1;LOD信噪比均要≥3:1
(4)ICH(Q3A、Q3B)中分析方法描述:定量限應(yīng)不大于(≤)報告限”,故有關(guān)物質(zhì)方法驗證/確認中進行定量限試驗時,需要提前計算一下該藥品的日服用劑量,然后從ICH指導(dǎo)原則中看一下報告限是多少,驗證/確認結(jié)果一定要與法規(guī)上的報告限進行對比,定量限不能大于報告限。
(5)如與CRO公司合作等,在接收、審核資料時也要注意。(常見問題,人員方法驗證作出的定量限大于ICH中的報告限)
(6)因檢測限、定量限除了方法的靈敏與否之外,受儀器性能影響較大。做檢測限與定量限時,注意要考慮到不同性能、不同品牌儀器的差異,一定不能刻意去挑選性能和靈敏度非常好的儀器進行試驗。
(7)為便于數(shù)據(jù)應(yīng)用及撰寫資料方便,每針單獨計算信噪比(報告中需要報出);計算出定量限/檢測限濃度,如0.0502ug/ml,同時計算出定量限/檢測限(相當(dāng)于供試品濃度的百分比)=定量限/檢測濃度/供試品濃度。
4、報告限:根據(jù)藥品的日服用劑量,詳見ICH指導(dǎo)原則(附圖1),其余見“五、報告閾值
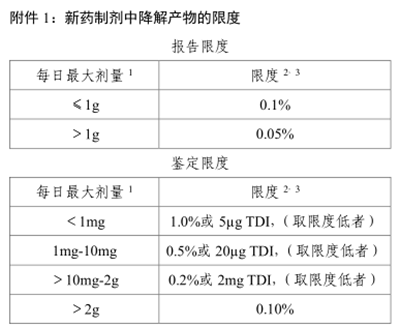
三、檢測限、定量限、報告限之間的關(guān)系是什么?
ICH中規(guī)定定量限≤報告限,檢測限又小于定量限,從而推得3者的關(guān)系:檢測限<定量限≤報告限。
聊到這里,可能有人著急了,那他們和忽略限的關(guān)系呢?不要著急,欲知關(guān)系如何,且聽下節(jié)分析。
四、聊聊“忽略限“?
說實話,這一節(jié)的標(biāo)題老王想了又想,覺得還是沒有合適的標(biāo)題,只能對”忽略限“先畫個問號,再逐步聊聊為什么。因為忽略限這個名詞在EP或USP中會見到,中國藥典則會描述為:“小于對照溶液XX倍的色譜峰忽略不計。”
USP在2022年01月份發(fā)了一個關(guān)于“USP通則<621>色譜法-重要標(biāo)準(zhǔn)協(xié)調(diào)”的通告,其中有一條” 術(shù)語"可忽略限度(Disregard limit)"被"報告閾值(Reporting thresholds)"取代“的內(nèi)容,計劃于 2022年12月1日起正式生效。此內(nèi)容老王甚是贊同,因為實際工作中有的叫做”忽略限“,有的叫做”報告限“,搞得分析人員一頭霧水,到底各自有什么作用?互相有什么關(guān)系?又有什么不同?怎么描述怎么叫才合適呢?
其實,不論是叫做“忽略限“還是”報告限“,他們的目的是一樣的,叫做“忽略限”,那么就是低于這個限度的雜質(zhì)可以不報告,等于和高于這個限度的雜質(zhì)需要報告;叫做“報告限”吧,等于或高于此限度的雜質(zhì)就需要報告,低于此限度的雜質(zhì)可不報告。
所以日常工作中,建議參考USP通則<621>色譜法中描述為報告閾值(Reporting thresholds)較為合適,就避免了人員糾結(jié)到底是忽略限呢還是報告限呢……
五、如何建立每個品種的“報告閾值“呢?
USP還在2021年發(fā)了一個關(guān)于“報告限”去留的內(nèi)容,其中說了FDA在多個藥品各論修訂意見中建議刪除各論中的“報告限“,美國FDA認為藥典各論無法對所有生產(chǎn)企業(yè)的每一個雜質(zhì)或降解產(chǎn)物進行鑒定和羅列,那么各論中設(shè)定“報告限”可能會導(dǎo)致產(chǎn)品中某些高毒性雜質(zhì)不被鑒定或報告。另外,美國FDA認為每個藥物有其各自的特性,“報告限”應(yīng)當(dāng)因產(chǎn)品而異,企業(yè)應(yīng)當(dāng)在藥物申請時做出說明,美國FDA也會參考ICH的報告限作為指導(dǎo)原則,對不同產(chǎn)品進行不同的考量。它是讓用戶基于藥物特性、最大攝入劑量等因素自主選擇“報告限”策略。USP則在接到美國FDA的意見后,開展了一系列工作, 后續(xù)可能在修訂時刪除已生效各論中的“報告限”,并通過凡例的形式對“報告限”的選擇提供指導(dǎo)規(guī)范。
老王期待著指導(dǎo)規(guī)范的發(fā)布,當(dāng)然我也從質(zhì)量控制與確保藥物的安全性角度考慮,建議大家建立各自產(chǎn)品”報告閾值“時,除了考慮ICH中的報告限,基于藥物的安全性、如服用劑量等,雜質(zhì)概況,還可考慮方法的靈敏度綜合制定。通常建議可用方法驗證得出的定量限作為該產(chǎn)品的報告閾值,即能確保雜質(zhì)結(jié)果準(zhǔn)確定量,又不高于ICH中的報告限,而不建議直接用ICH中的報告限直接作為報告閾值。
六、檢測限、定量限、報告閾值如何應(yīng)用?
方法驗證完成后,可將檢測限(LOD)、定量限(LOQ)應(yīng)用于后續(xù)的Sop編寫中,對分析人員合理報出檢驗結(jié)果具有指導(dǎo)意義。通常:
1、定量限的應(yīng)用:
(1)可參考其制定”報告閾值“
(2)大于定量限的,即能夠準(zhǔn)確報出結(jié)果的直接報告數(shù)值即可。小于定量限的,可以報告小于定量限(<LOQ),同時可將LOQ備注出來。
結(jié)果報告示例:RRT約為1.8的雜質(zhì)<LOQ(0.03%)。
2、檢測限的應(yīng)用:
(1)很多小伙伴對于積分參數(shù)的設(shè)置存有很多疑惑,那么,如果你做了檢測限,則可參考檢測限設(shè)置最小峰面積等制訂合理的積分參數(shù),低于檢測限可不進行積分,避免過多的雜峰或基線波動干擾;大于檢測限的色譜峰則積分、計算(積分、計算是為了分析雜質(zhì)變化趨勢用)。
(2)可用于指導(dǎo)結(jié)果報告。如果檢測數(shù)據(jù)較小,小于檢測限,則可報告小于檢測限(<LOD)同時可將LOD備注出來。例如,RRT約為0.8的雜質(zhì)<LOD(0.01%);對于小于檢測限的情況也可報告為未檢出,具體按照哪種方式報告,需要在各自管理文件中作出明確規(guī)定。
3、報告閾值的應(yīng)用:
前邊說了為了分析各雜質(zhì)的變化趨勢,對于大于檢測限的雜質(zhì)要積分、計算,那么是否需要報告呢?則需要視情況而定。若雜質(zhì)含量超過可以報告的限度(如定量限、報告閾值)則可報告出單雜及可計入總雜質(zhì)。
結(jié)語:以上為個人理解與經(jīng)驗,如有不妥,敬請指正。
參考資料:
ICH Q2 分析方法驗證
ICH Q3A 新原料藥中的雜質(zhì)
ICH Q3B 新制劑中的雜質(zhì)
USP關(guān)于“報告限”的去留(2021.12.07)
USP通則<621>色譜法