
江蘇吉泰肽業科技有限公司
聯 系 人 :秦經理
座 機 :0515-84130555
手 機:17705109088
郵 箱:info@gtaipeptide.com
地 址:江蘇省鹽城市濱海縣新安大道799號
網 址:cn-cat.com.cn
郵 編:224500
一、前言
提起口服多肽,相信大家首先想到的肯定是近年來風頭正勁的諾和諾德公司GLP-1類似物口服索馬魯肽。2019年絕對是口服索馬魯肽的豐收年,面對早已是一片紅海的糖尿病領域,口服索馬魯肽在降糖、減重、保護心血管系統與腎臟等領域四面出擊。在PIONEER 2和PIONEER 7兩項與目前標準療法的頭對頭臨床實驗中,口服索馬魯肽分別擊敗同為口服降糖制劑的禮來SGLT-2抑制劑(恩格列凈,Jardiance)與默沙東DPP-4抑制劑(西格列汀,Januvia)。同時,在PIONEER 4中與自家前輩利拉魯肽相比,口服索馬魯肽也在降糖方面獲得了非劣性結果。此外,被禮來寄予厚望的GIP/GLP-1雙靶點激動劑(Tirzepatide),雖然在一項6個月的2型糖尿病IIb期臨床研究中展現了令業界乍舌的降糖與減重效果(高劑量組HbA1C降低2.4%、減重11.3公斤),但也伴隨著高達32%的12周退組率。結合其它雙靶點、三靶點激動劑不盡如人意的臨床結果,禮來是否能為Tirzepatide找到最安全、最理想的治療窗,目前看來還是個大大的問號。基于上述臨床數據,剛剛上市的口服索馬魯肽看似已有在糖尿病領域統一六國之勢,但在小編看來,口服索馬魯肽作為第一款真正意義上的口服大分子藥物,將有可能對改變大分子藥物治療格局,歷史地位不愧于其系列臨床研究的名稱PIONEER。
我們將在本篇內詳細討論口服多肽藥物國際研發現狀,主要分為口服多肽主要壁壘、口服多肽結構優化與口服多肽藥物遞送系統三大方面。由于篇幅有限,本文主題是多肽藥物吸收,將重點介紹以促滲透劑為主的口服多肽給藥系統,未來可就口服索馬魯肽臨床實驗設計與數據分析、大分子藥物腸道吸收所涉及的解剖與生理知識、天然口服多肽的結構優化與經驗借鑒等內容單獨成文闡述,此處便不過度贅述。

二、口服多肽主要壁壘
口服抗體或多肽等大分子藥物始,終是制劑研發領域的主要方向,尤其對于2型糖尿病等慢性疾病患者。由于,疾病早期階段對患者生活質量影響較小,不同給藥方式對患者生活的影響直接決定了依從性與藥品銷量。GLP-1賽道產品的不斷更迭就是上述觀點最經典的案例(Exenatide, bid/s.c. ? Liraglutide qd/s.c. ? Dulaglutide qw/s.c. ? Semaglutide qd/p.o.)。為此,諾和諾德、禮來等糖尿病領域巨頭在上世紀末就已開始不遺余力的尋找有效的口服GLP-1解決方案了。但為什么經歷了30余年的努力,目前僅有口服索馬魯肽成功上市哪?這就要從以下兩方面來詳細介紹一下多肽藥物口服的主要壁壘所在了。
1、化學壁壘
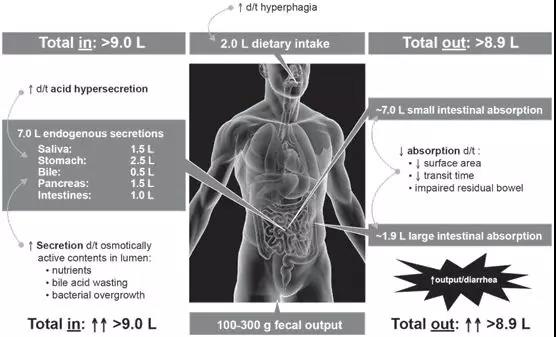
人體消化系統分為消化道與消化腺,消化道主要包括口腔、食道、胃、十二指腸、空腸、回腸與結直腸,消化腺則主要指具有相關消化酶等分泌功能的腮腺、胰腺與肝臟。消化系統的主要生理功能是消化食物與吸收水、電解質及各類營養物質(糖、脂、蛋白質)。人體各項生理功能所需的能量消耗及組織合成代謝原料,均需通過對食物的消化與吸收供給。但在食物所提供的營養物質中,除維生素、水和無機鹽可以被直接吸收利用外,蛋白質、脂肪和糖類等物質均不能被機體直接吸收利用,需在消化道內被分解為結構簡單的小分子物質,才能通過腸粘膜屏障,被吸收進入血液和淋巴液。為了能夠將攝入的食物充分消化,人體每日消化道分泌的消化液平均可達到9 L,主要包括強酸性的胃液與強堿性的腸液、胰液與膽汁,其中大部分可被末端回腸與結腸重吸收。如此大量、且具有強腐蝕性的消化液,足以將所有進入消化道的蛋白質均分解為單個氨基酸,但這對多肽、單克隆抗體等大分子藥物則是滅頂之災。
2、物理壁壘
除消化液對大分子藥物的分解作用外,腸粘膜表面所覆蓋的粘液層,以及腸粘膜細胞及細胞間緊密連接等構成的腸粘膜屏障,對于普通多肽及大分子藥物都是不可能逾越的生理屏障。由粘蛋白與糖蛋白構成的粘液層,覆蓋了全部胃腸道粘膜,為通過消化道的食糜起到潤滑作用,同時可以有效地避免腸粘膜細胞與各類微生物及有毒物質接觸,是人體與外界環境的一道重要屏障。各類粘蛋白與糖蛋白彼此間通過二硫鍵結合形成高度糖基化的大分子物質,從而有效避免被消化液內的各類蛋白酶水解。粘液層內分子間結構的孔洞大小、所帶電荷、以及共價分子數量,均可直接影響多肽等大分子藥物的通過性。由化學或生物合成的相關粘蛋白,可在體外模型中有效模擬粘液層的理化性質,已有大量實驗模型可以對不同多肽分子穿透粘液層的能力進行早期評估。
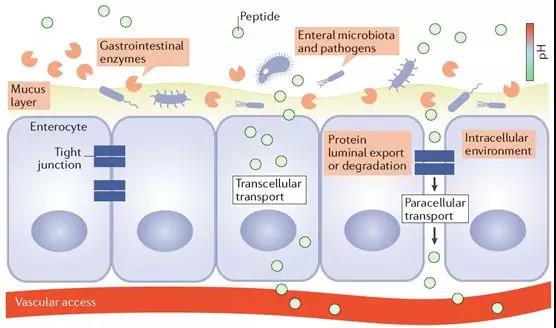
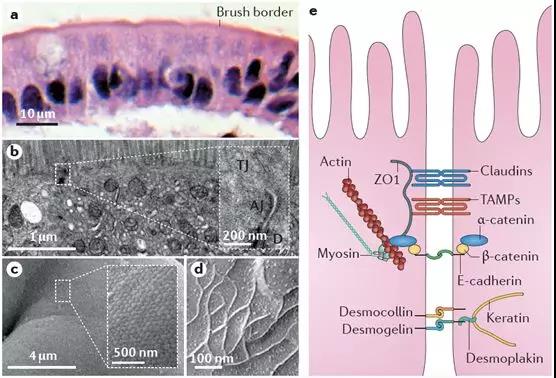
穿過粘液層后,即是腸粘膜上皮細胞的刷狀緣了。從下圖的病理與電鏡圖片中可以看到,腸粘膜上皮細胞以單細胞層形式緊密排列,細胞與細胞之間則由緊密連接結構進行封閉。任何通過腸道被吸收的物質,都只能通過腸粘膜上皮細胞或經細胞旁的緊密連接結構,吸收入粘膜下毛細血管或淋巴管網絡。盡管腸粘膜細胞刷狀緣細胞膜上分布著大量轉運蛋白、離子通道等,既可以用來吸收腸腔內的水、電解質及營養物質,也可以向腸腔內分泌相關物質調節機體內穩態。但正如上文所述,無論是糖類、脂肪、還是蛋白質,都必須被分解為最基本形式的單糖、脂肪酸及氨基酸后,才可以穿過腸粘膜屏障被吸收。由緊密連接、粘附鏈接及細胞橋粒所封閉的細胞旁通路,在正常生理情況下,僅可以與腸腔內物質進行水和電解質的交換。此外,構成緊密連接等細胞旁通路的相關蛋白功能一旦受損,將造成嚴重腹瀉等危險情況。
三、口服多肽結構優化
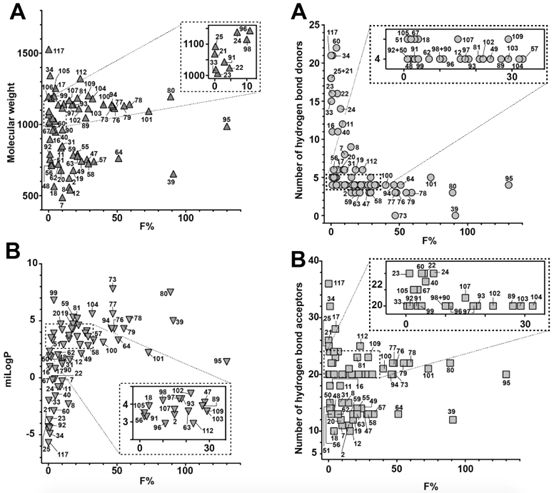
自Christopher Lipinski提出著名的“Rule of 5”(分子量小于500 Da、氫鍵供體少于5個、氫鍵受體少于10個、可旋轉鍵少于10個、脂水分配系數對數值在-2至5之間)理論之后,小分子藥物開發領域基本都嚴格遵循這一經典理論,但對于多肽及大分子生物藥物來說,則完全不可能滿足“Rule of 5”的所有要求。由于多肽分子普遍具有較高的極性、較大的極性表面積、大分子量、低脂溶性、高清除率、易降解等諸多缺點,口服多肽幾乎是不可能實現的給藥方式。然而,現實中也存在著特例,例如臨床廣泛使用的環孢素及去氨加壓素這兩個天然大環肽分子,卻分別具有30%和0.17%的口服生物利用度。Daniel Nielsen等對125種具有不同口服生物利用度的天然環肽分子進行分析后總結到:對于環肽分子而言,分子量大小并不是影響生物利用度的主要原因;與氫鍵受體數量相比,氫鍵供體對生物利用度的影響更大;至于可旋轉鍵問題,則可通過將肽鏈環化、增加分子剛性克服;而極性表面積在分析結果中并未體現出關鍵作用。此外,肽鏈的環化有助于內化分子中的氫鍵、極性分子、以及酶切位點,可以有效降低分子極性、減少極性表面積、增加脂溶性與分子剛性,有助于增加多肽分子對細胞膜的滲透性。
上文中已提到2019年10月Zealand Pharma為了口服大環肽相關技術,斥資8000萬美元收購新型口服多肽公司Encycle Therapeutics(“三浪并發”關鍵時刻,展望新型多肽藥物研發),可見口服大環肽改造已獲得業界認可,而不是單純限于實驗室的早期技術。但此處小編需要強調,口服多肽與穿膜多肽之間還是存在較多差異,例如口服多肽更多強調抗消化液強酸強堿腐蝕與各類蛋白酶降解,由于可借助各類促滲透劑等藥物遞送系統增加生物利用度,只需同時兼具一定的細胞膜滲透性即可。與口服多肽不同,穿膜多肽的主要臨床需求則是協助各類不能直接進入細胞內的藥物穿透細胞膜,并作用于相關細胞內靶點。從臨床需求出發,穿膜多肽的重點在于有效觸達細胞內靶點,因此脂溶性、弱極性、減少分子內氫鍵、以及與linker及payload的穩定高效偶聯等特性,才是穿膜多肽設計與優化的主要方向。

四、口服多肽藥物遞送系統
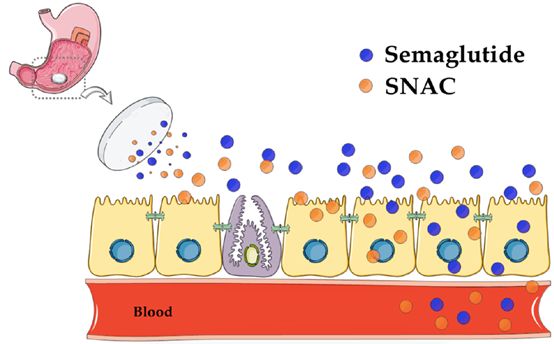
藥物遞送系統是本篇文章的主要重點,因為小編認為口服索馬魯肽之所以實現了口服大分子藥物的突破,主要是因為促滲透劑辛酸鈉(Salcaprozate Sodium, SNAC)與索馬魯肽的完美契合。作為GLP-1的長效類似物,索馬魯肽分子為傳統線性肽,分子本身完全不具備任何口服生物利用度。SNAC通過非特異性的增加腸粘膜屏障通透性,使索馬魯肽可在短時間內穿透腸粘膜上皮細胞,從而被腸粘膜下毛細血管吸收入血。盡管與SNAC混合后,最終口服索馬魯肽制劑僅有約1%的口服生物利用度,但對于極度渴求減少注射次數的2型糖尿病患者來說,安全有效的口服制劑將大幅度提高生活質量。下文將分兩大部分,分別介紹目前最主要的兩類促滲透劑SNAC與癸酸鈉(Sodium Caprate, C10)。目前,也有大量胰島素微針注射器與腸道貼片等藥物器械的臨床研究,但考慮到制劑成本、治療人群、消化道基礎疾病等限制條件,顯然促滲透劑才是當下口服多肽藥物的主要選擇,因此其它藥物遞送系統本文暫不做贅述。
1、促滲透劑(Permeation Enhancer, PE)
在口服大分子的眾多體內及體外實驗中,表面活性劑、膽汁酸鹽、細菌毒素、螯合劑、中鏈脂肪酸等,都表現了不同程度的促滲透作用。目前為止,真正被應用于人體實驗的促滲透劑只有SNAC、C10、中鏈脂肪酸、膽汁酸鹽及八碳衍生物。C10的主要代表是Elan Pharma開發的GIPET口服固體制劑給藥系統,隨后將口服多肽技術授權給了Merrion Pharmaceuticals。現在眾所周知的SNAC,則源自美國公司Emisphere開發的Eligen給藥系統。諾和諾德早已明確了GLP-1賽道將向長效及口服發展,為此他們在上世紀九十年代就開始了各類口服胰島素及口服GLP-1的探索,為此他們同時license in了GIPET和Eligen給藥系統。經過充分的前期對比后,諾和諾德最終選擇了具有高激動活性、長半衰期的索馬魯肽與SNAC制成口服片劑,自此開啟了口服索馬魯肽的傳奇之旅。

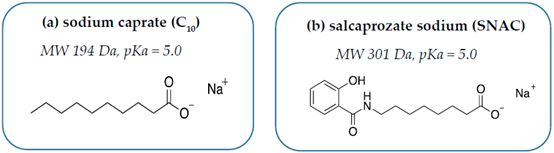
2、C10
C10是癸酸鈉,屬于飽和中鏈脂肪酸,早已被美國及歐盟批注用作食物添加劑,并且是氨芐青霉素直腸栓劑(Doktacillin)的主要輔料之一。C10是一種對溶液pH值及離子強度敏感的陰離子表面活性劑,在胃部等強酸性環境下為不可溶的失活狀態,在小腸等堿性環境下可激活其類去污劑活性。大量的體外實驗已證實,C10在低濃度(2.5 mM)時主要通過可逆性干擾腸粘膜上皮細胞旁路增加大分子滲透性,在高濃度(8-13 mM)時則會直接影響腸粘膜結構與細胞旁通路。上文提及愛爾蘭公司Merrion Pharma license inGIPET給藥系統后,分別嘗試結合胰島素、去氨加壓素、抗過敏寡核苷酸等大分子,并開展了相關臨床研究,但結果不盡如人意。至今,除氨芐青霉素直腸栓劑外,尚無任何一款以C10作為遞送系統的藥物獲批。
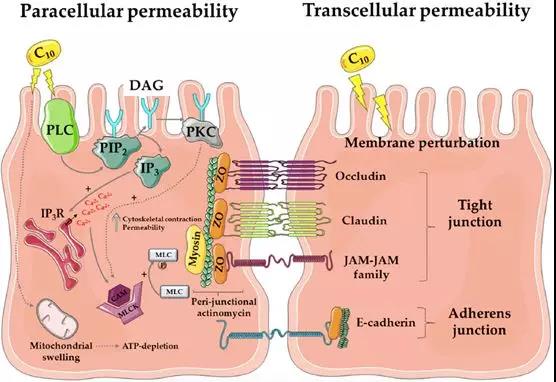
3、SNAC
SNAC是一種化學合成的水楊酸乙酰氨基酸衍生物,最早是由Emisphere公司在眾多促滲透劑中篩選出來的高效分子。以SNAC作為主要輔料的口服維生素B12早先已被批準為醫用食品上市,SNAC同時被FDA認定為食品安全物質(generally recognized assafe, GRAS)。與C10相同,可與API直接混合制成無包衣口服片劑,易于控制制劑生產成本及規模化。上世紀九十年代,Emisphere 公司曾進行多項以SNAC為主要輔料的口服肝素制劑臨床實驗,但始終未獲得FDA批準,也導致了公司CEO及早期研發人員大量離職,并將SNAC轉讓給諾和諾德進一步開發。早期Emisphere研發團隊認為SNAC通過非共價鍵形式與payload結合后,可使后者構型改變,暴露更多疏水區域,從而有利于增加細胞膜滲透性。在17 mg/mL濃度下,SNAC可有效提升胰島素對Caco-2單細胞膜的滲透性,但激光共聚焦顯微鏡發現熒光標記甘露醇分子則仍然無法通過,這充分證明SNAC并不是通過開放緊密連接或破壞腸粘膜屏障完整性來提高胰島素通過能力的。但目前為止,對于SNAC是否影響細胞旁路緊密連接結構仍未有定論。
經過諾和諾德公司多年來的不懈努力,2019年9月20日FDA正式批準口服索拉魯肽上市治療2型糖尿病。與C10及大部分傳統觀點不同,諾和諾德公司在相關報告中表述口服制劑在胃內分級后,SNAC可有效增加索馬魯肽分子周圍局部pH值,阻止胃蛋白酶對多肽的降解,并通過與腸粘膜上皮細胞刷狀緣的接觸,在細胞膜表面借助濃度梯度使索馬魯肽穿透胃黏膜后吸收入血。再次驗證了SNAC對大分子生物利用度的提升,并不是通過對腸粘膜屏障的破壞而實現的。對于促滲透劑安全性的質疑一直存在,特別是腸道內不但有外界食糜帶入的致病原,本身腸道內定植的大量微生物及相關產物,如果與藥物大分子一同被吸收入血,將造成類似腸粘膜屏障破壞后菌群易位的嚴重并發癥,可能引起生命危險。但無論是作為普通食品或醫用食品添加劑,還是多年來各項以C10和SNAC為主的臨床研究,都未曾有任何菌群易位的嚴重不良反應報道。如果我們來仔細計算一下,促滲透劑通常結合的payload大分子藥物分子量均小于10 kDa,但細菌、病毒、以及細菌致病原脂多糖等分子量均大于100 kDa,可見對于促滲透劑引起腸道微生物或毒素進入體內的擔憂確實有些杞人憂天了。
除了上述優勢外,SNAC等促滲透劑當然存在諸多問題。首先,盡管口服索馬魯肽可以有效避免2型糖尿病患者常年的皮下注射,但在比較每周一次的皮下注射與每日口服的區別時,感受上的差距似乎已不是非常明顯。況且,為了實現更好的生物利用度等目的,口服索馬魯肽要求禁食禁水6小時候方可服用,且服藥后半小時不可進餐,這同樣給患者帶來了不適體驗。此外,僅有約1%的生物利用度,也使得口服索馬魯肽片劑的原料藥成本顯著高于長效注射劑,這無疑將增加口服索馬魯肽制劑的終端售價。如果未來出現更長效的GLP-1制劑,相信廣大2型糖尿病患者們可以做一道簡單計算題,看看為了躲避皮下注射而花費的額外治療費用是否值得。最后,還是要討論一下安全問題,雖然SNAC等促滲透劑不會造成菌群易位等嚴重影響,但由于腸道內消化液pH值等環境條件變化巨大,促滲透劑對payload生物利用度的增加同樣存在巨大波動。因此,只有像GLP-1類似物這類治療劑量與危險劑量相差巨大的安全藥物才適合采用促滲透劑方式給藥,多肽藥物治療窗的大小將是評估其是否適合口服給藥的關鍵點。
小編總結
口服多肽已明確成為多肽藥物發展的未來趨勢,盡管目前僅有口服索馬魯肽獲批上市,但其對GLP-1賽道的顛覆效果已世人皆知。小編認為口服多肽固然優勢巨大,但是否可以復制口服索馬魯肽的優異戰績還需要謹慎考慮。例如,從PK等數據角度分析,同樣使用SNAC作為促滲透劑的口服索馬魯肽與未被批準的口服降鈣素相差無幾。然而,由于索馬魯肽擁有更長半衰期,以及更寬闊的治療窗,為其安全有效的臨床結果打下了堅實基礎。顯然SNAC并不是萬能鑰匙,我們需要更好的理解它的作用原理,從而為其找到理想的使用場景與合作伙伴(payload)。